$200 — і я скажу хто ти
Досить відправити зразок слини, щоби дізнатися про минуле і майбутнє та схильність до хвороб — так працює один із найвідоміших сервісів дослідження людського геному. Все почалося з гену lrrk2, 12-ї хромосоми. Його генетична мутація пов’язана з виникненням хвороби Паркінсона із статистичною можливістю 30—75%. Поміж мільйонів осіб, які приховують у своїх клітинах цю хворобу, є також Сергій Брін, співзасновник Google, який фінансує дослідження цього захворювання.
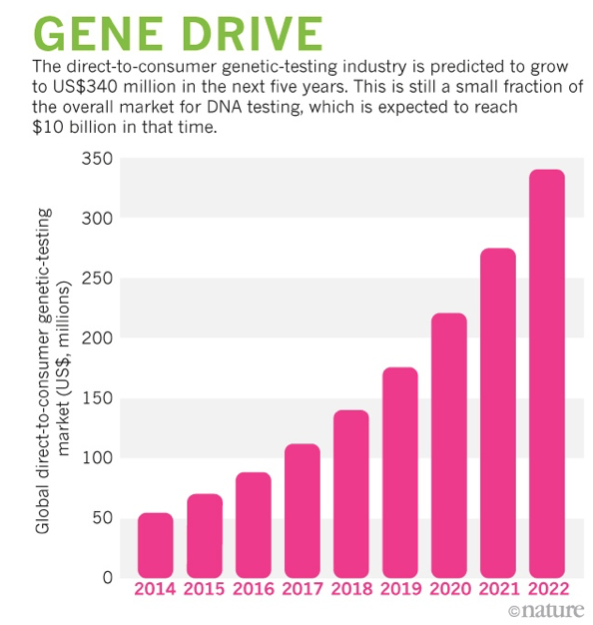
У 2006 році була створена 23andMe — компанія, яка займається генетикою та пропонує тест ДНК за цінами, прийнятними для звичайного споживача. Одним з головних інвесторів компанії є Google. Секвенувати ДНК коштує все менше. Це відкриває можливість створити базу даних навіть на приватному рівні. Останніми роками вартість аналізів зменшилася, а число компаній, що пропонують тест ДНК менше ніж за $200, зросло. Відтак цей ринок просто «вибухнув». У 2015 році він оцінювався у $70 млн. А до 2022 року прогнозують, що він зросте уп’ятеро — до $340 млн.
Сьогодні досить відправити зразок слини до Маунтін-В’ю, сплатити трохи менше $200 та зачекати декілька днів. Із базою у понад 2 млн секвенованих ДНК, 23andMe це на сьогодні — справді найбільший у світі архів генетичної інформації, зібраної з науковою метою. 80% їхніх пацієнтів вирішили анонімно залишити свої генетичні дані для того, аби компанія могла пришвидшити дослідження людського геному.
Структура сайту, до якого має доступ той, хто робить тест, — така сама, як у соціальної мережі. Можна обрати чи тримати профіль анонімно та ділитися з кимось певною інформацією (чи ні). Кожного разу, коли стає відомо про когось у світі, хто має певний відсоток спорідненості і пройшов той самий тест, програма вас про це повідомить. Також можна вирішити, чи додати в «друзі» свого можливого «родича», чи ні.
Деякі науковці все ж ставлять під сумнів точність таких тестів ДНК. Існує думка, що сімейна історія є потужнішим індикатором для прогнозування ризику більшості захворювань, ніж гени. До того ж, чимало «смертельних» генних мутацій виявляються нешкідливими.
23andMe має у планах продавати ДНК-дані клієнтів для розробки ліків. Фармацевтичні компанії намагаються видобути генетичні дані для розробки ліків протягом щонайменше десятиліття, та поки немає значного успіху в цьому напрямку. Наприклад, deCODE GENETICS, заснована в Рейк’явіку у 1996 році, залучила близько половини дорослого населення Ісландії в генетичне дослідження. Незважаючи на те, що дослідження компанії дало змогу ознайомитись з генетичними механізмами захворювання, воно не дало достатніх результатів для створення ліків.
Є побоювання, що тести ДНК можуть завдавати шкоди пацієнтам – люди можуть вдаватися до радикальних медичних заходів на підставі результатів їх тестування, наприклад, вирішуючи змінити дозування своїх ліків без консультації з лікарем або проводити непотрібні операції (такі як мастектомія або лікування, що базується на помилкових даних). Щоб уникнути цього, пацієнти мають бути добре проінформованими про те, що означають результати тестів.
CRISPR — олівець, що редагує ДНК та РНК без розрізання
2 нових варіанти технологічної платформи для геномного редагування дозволять модифікувати одиничні літери, які складають ДНК та РНК без розрізання, як це здійснюється у класичній версії CRISPR (короткі паліндромні повтори, регулярно розташовані групами CRISPR — Clustered Regularly Interspaced Short Palindromic Repeats), що використовує молекулярні ножиці.
Система RISPR еволюціонувала, і для виправлення мутацій більше не потрібно різати. 2 статті, опубліковані у виданнях Nature та Science, сповістили про появу двох нових варіантів цієї технологічної платформи для редагування геному. Йдеться про реальні автоматичні коректори помилок (base editor), які замінюють молекулярні ножиці класичної версії CRISPR.
Основна відмінність між цими 2 новими варіантами платформи CRISPR, представленими сьогодні, — те, що один працює з ДНК, роблячи довготривалі зміни у геномі, інший – втручається у РНК-транскрипти зі змінним ефектом. Зазвичай вони працюють за таким принципом: коли ідентифікують помилкову літеру (за правилами Міжнародного союзу теоретичної і прикладної хімії (IUPAC) використовуються такі літери), то делікатно виправляють атоми, змінюючи ідентичність: A = аденін; C = цитозин; G = гуанін; T = тимін; R = G A (пурин); Y = T C (піримідин); K = G T (кето); M = A C (аміно); S = G C (сильне зв’язування); W = A T (слабке зв’язування); B = G T C (всі, крім A); D = G A T (всі, крім C); H = A C T (всі, крім G); V = G C A (всі, крім T);N = A G C T (будь-який).
Таким чином, послідовність літер ДНК виправляється без необхідності розрізати, і без неточностей, які виникають при активації природного механізму клітинного відновлення. Новий підхід більш ефективний за альтернативні процедури і дозволяє проводити втручання із високою точністю та мінімальною вірогідністю помилок. Сподіваємося, що в майбутньому ці перетворювачі літер ДНК можуть бути використані для відновлення точкових мутацій, що спричиняють багато серйозних захворювань людини.
Як відомо, існує 4 літери ДНК: аденин поєднується з тиміном, а гуанін – з цитозином. У минулому році Девід Лью з Broad Institute вже проілюстрував в науковому журналі Nature, як перетворити пару G-C на пару T-A. Але для виправлення багатьох патологічних мутацій необхідний зворотний перехід та результати останніх відкриттів, здійснених цим дослідником, які полягають в тому, що зараз можна замінити всі 4 літери ДНК — як в бактеріях, так і в клітинах людини.
Якщо ми уявимо собі CRISPR як швейцарський ніж, Лью і його колеги спочатку знівелювали функцію «відрізу». А потім як еквівалент вони використали «олівець», який виправляє помилки. Олівець, в переносному сенсі, відповідає функціям ферментативної (деамінази), здатний віднімати хімічні групи з літерами ДНК, щоби перетворювати один тип на інший. Для того, щоб активувати білок, який є основним інгредієнтом нового рецепта (TadA- dCas9), дослідники змушені були опрацювати 7 циклів еволюції та інженерії. Зусилля не були марними. Врешті-решт система показала, що вона в змозі коригувати мутації, пов’язані з 2 генетичними захворюваннями — серповидно-клітинною анемією та гемохроматозом.
Технологія CRISPR бере початок з бактеріальної природної системи, яка є свого роду невичерпною «копальнею» молекулярного біорізноманіття. Чекаємо на те, що набір інструментів CRISPR збагатиться оптимальними варіантами для виконання різних завдань щодо корекції, вставлення або видалення інерційних елементів.
